Межмолекул я рное взаємодій е йствіе. взаємодія між електрично нейтральними молекулами або атомами; визначає існування рідин і молекулярних кристалів. відміну реальних газів від ідеальних і виявляється в різноманітних фізичних явищах. Міжмолекулярної взаємодії залежить від відстані r між молекулами і, як правило, описується потенційною енергією взаємодії U (r) (потенціалом міжмолекулярної взаємодії), так як саме середня потенційна енергія взаємодії визначає стан і багато властивостей речовини.
Вперше міжмолекулярної взаємодії взяв до уваги Я. Д. ван дер Ваальса (1873) для пояснення властивостей реальних газів і рідин. Ван дер Ваальса припустив, що на малих відстанях r між молекулами діють сили відштовхування, які зі збільшенням відстані змінюються силами тяжіння. На основі цих уявлень, навіть не розглядаючи кількісної залежності міжмолекулярної взаємодії від відстані, він отримав так зване Ван-дер-Ваальса рівняння стану реального газу.
Міжмолекулярної взаємодії має електричну природу і складається з сил тяжіння (орієнтаційних, індукційних і дисперсійних) і сил відштовхування.
Орієнтаційні сили діють між полярними молекулами. тобто володіють дипольними електричними моментами (див. Диполь електричний). Сила тяжіння між двома полярними молекулами максимальна в тому випадку, коли їх дипольні моменти розташовуються уздовж однієї лінії (рис. 1). Ця сила виникає завдяки тому, що відстані між різнойменними зарядами трохи менше, ніж між однойменними. В результаті тяжіння диполів перевершує їх відштовхування. Взаємодія диполів залежить від їх взаємної орієнтації, і тому сили дипольної взаємодії називаються орієнтаційними. Хаотичний тепловий рух безперервно міняє орієнтацію полярних молекул. але, як показує розрахунок, середнє по всіляких орієнтаціям значення сили має певну величину, що не рівну нулю. Потенційна енергія орієнтаційного міжмолекулярної взаємодії Uор (r)
r -7. Сила Fор зменшується з відстанню значно швидше, ніж кулоновская сила взаємодії заряджених тіл (Fкул
Індукційні (або поляризаційні) сили діють між полярною і неполярной молекулами. Полярна молекула створює електричне поле, яке поляризує молекулу з електричними зарядами, рівномірно розподіленими за об'ємом. Позитивні заряди зміщуються у напрямку електричного поля, а негативні - проти. В результаті у неполярной молекули індукується дипольний момент.
p1 a 2 / r 6. Ця енергія називається індукційною, так як вона з'являється завдяки поляризації молекул. викликаної електростатичного індукції. Індукційні сили (Fінд
Між неполярними молекулами діє дисперсійне міжмолекулярної взаємодії. Природа цієї взаємодії була з'ясована повністю лише після створення квантової механіки. В атомах і молекулах електрони складним чином рухаються навколо ядер. В середньому за часом дипольні моменти неполярних молекул виявляються рівними нулю. Але в кожен момент електрони займають якесь положення. Тому миттєве значення дипольного моменту (наприклад, у атома водню) відмінне від нуля. Миттєвий диполь створює електричне поле, поляризующее сусідні молекули. В результаті виникає взаємодія миттєвих диполів. Енергія взаємодії між неполярними молекулами є середній результат взаємодії всіляких миттєвих диполів з дипольними моментами. які вони наводять в сусідніх молекулах завдяки індукції. Потенційна енергія дисперсійного міжмолекулярної взаємодії Uдісп (r)
r -7 (тут a 1 і a 2 - поляризуемости взаємодіючих молекул). Міжмолекулярної взаємодії даного типу називається дисперсійним тому, що дисперсія світла в речовині визначається тими ж властивостями молекул. що і це взаємодія. Дисперсійні сили діють між усіма атомами і молекулами. так як механізм їх появи не залежить від того, чи є у молекул (атомів) постійні дипольні моменти чи ні. Зазвичай ці сили перевершують по величині як орієнтаційні, так і індукційні. Тільки при взаємодії молекул з великими дипольними моментами. наприклад молекул води. Fор> Pдісп (в 3 рази для молекул води). При взаємодії ж таких полярних молекул. як CO, HI, HBr та інших, дисперсійні сили в десятки і сотні разів перевершують всі інші. Дуже істотно, що всі три типи міжмолекулярних взаємодій однаковим чином зменшуються з відстанню:
Сили відштовхування діють між молекулами на дуже малих відстанях, коли приходять в зіткнення заповнені електронні оболонки атомів. що входять до складу молекул. Існуючий в квантовій механіці Паулі принцип забороняє проникнення заповнених електронних оболонок один в одного. Виникаючі при цьому сили відштовхування залежать більшою мірою, ніж сили тяжіння, від індивідуальності молекул. До хорошого згодою з даними експериментів приводить допущення, що потенційна енергія сил відштовхування Uот зростає зі зменшенням відстані згідно із законом Uот (r)
Якщо прийняти, що U (r) = 0 при r ® ¥. і врахувати, що енергія тяжіння убуває із зменшенням відстані пропорційно r -6. а енергія відштовхування зростає як r -12. то крива U (r) буде мати вигляд, зображений на рис. 2. мінімум потенційної енергії відповідає відстань, на якому сили взаємодії молекул дорівнюють нулю.
Розрахувати з достатньою точністю U (r) на основі квантової механіки при величезній різноманітності пар взаємодіючих молекул практично не можна. Не вдалося визначити поки і експериментально виміряти силу взаємодії на міжмолекулярних відстанях. Тому зазвичай підбирають таку формулу для U (r), щоб виконані з її допомогою розрахунки добре б узгоджувалися з експериментом. Найбільш часто користуються формулою
так званим потенціалом Леннарда-Джонса. Вхідні у формулу величини s і e визначаються експериментально на основі залежності властивостей речовин (наприклад, коефіцієнти дифузії. Теплопровідності або в'язкості) від s і e.
Літ. Радченко І. В. Молекулярна фізика, М. 1965; Коулсон К. Міжатомні сили - від Максвелла до Шредінгера, «Успіхи фізичних наук», 1963, т. 81, ст. 3; Гіршфельдер Дж. Кертисс Ч. Берд Р. Молекулярна теорія газів і рідин. переклад з англійської, М. тисячу дев'ятсот шістьдесят-один.
Мал. 1. Два електричні диполі ab і cd при зазначеному взаємне розташування притягуються, т. К. Різнойменні заряди в точках b і з взаємодіють сильніше, ніж однойменні заряди в точках а і з (а також в b і d).
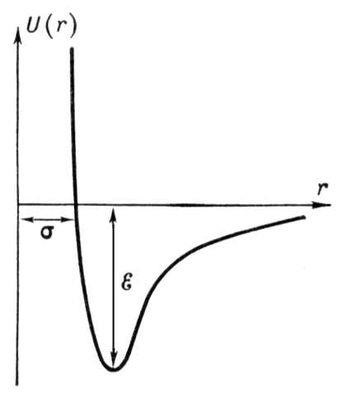
Мал. 2. Залежність потенціалу U (r) міжмолекулярної взаємодії Леннарда-Джонса від відстані r між молекулами. Відстань r = s - найменша можлива відстань між нерухомими молекулами. e - глибина «потенційної ями» (енергія зв'язку молекул).
