Технологія виробництва полиакрилонитрила
Полімер нітрит акрилової кислоти (поліакрилонітрил) був вперше отриманий Моро в 1893 р з етіленціангідріна і аміду акрилової кислоти. Потім в 1931 р Карозерс розробив метод отримання латексів з полиакрилонитрила. Пізніше, в 1940 році був запропонований метод сополимеризации акрилонітрилу з бутадієном (нітрильних каучук).
Оскільки поліакрилонітрил не розчиняються у відомих органічних розчинниках, його неможливо було переробляти в волокна. Вперше волокно з полиакрилонитрила отримали з використанням в якості розчинника диметилформаміду.
Пізніше було встановлено, що поліакрилонітрил розчиняється в концентрованому водному розчині роданида натрію або кальцію. Це мало велике значення для удосконалення технології отримання полиакрилонитрила.
Поліакрилонітрил й сополімери на його основі знайшли широке застосування у виробництві волокон широкого призначення, бутадієн-нитрильного каучуку, ударостійкого полістиролу та інших продуктів [1, С. 132].
1. Структура полиакрилонитрила
Поліакрилонітрил - труднокрісталлізующійся лінійний, карбоцепні полімер білого кольору. Структурна формула:
Методом ЯМР вдалося встановити, що мікроструктура полиакрилонитрила залежить від умов полімеризації акрилонітрилу. У присутності радикальних ініціаторів (наприклад, перекису бензоїлу, окислювально-відновних систем) при 40-80 ° С, а також аніонних каталізаторів (бутиллітію) або під дією -випромінювання при -78 ° С утворюється поліакрилонітрил одночасно сіндіо- і ізотактичний структури (1: 1). При отриманні полиакрилонитрила в канальних комплексах (наприклад, в комплексі акрилонітрилу з сечовиною) при -78 ° С і радіаційному ініціюванні частка ізотактичний структури зростає до 75-90%.
Залежність між молекулярною масою і характеристичної в'язкістю [], яка визначається в диметилформаміді (С = 2-20 м / л) при 20 ° С, виражається рівнянням [] = K * 10 -3 * M. в якому До і відповідно попарно рівні: 1,75 і 0,66; 2,5 і 0,66; 0,233 і 0,75; 0,166 і 0,81; 0,392 і 0,75; 0,34 і 0,73; 0,317 і 0,746; 0,278 і 0,76. величини цих коефіцієнтів залежать від способу приготування розчину акрилонітрилу [3, С. 354].
Молекулярно-масовий розподіл полиакрилонитрила, відповідне переважному способу обриву ланцюга (рекомбинацией), характеризується кривою з одним максимумом в разі гомогенної полімеризації (при відсутності -модифікує середовища, наприклад, диметилформаміду або роданидов) і кривої з трьома максимумами в разі гетерофазной полімеризації. Спеціальні види волокон (міцні, термостійкі) формують з полиакрилонитрила, що характеризується вузьким молекулярно-масовим розподілом, т. К. Максимально можлива при витяжці орієнтація зменшується зі збільшенням полідисперсності. Поліакрилонітрил з найбільш вузьким молекулярно-масовим розподілом утворюється при анионной полімеризації акрилонітрилу. При радикальної полімеризації акрилонітрилу в гетерогенних умовах утворюється поліакрилонітрил з найбільш широким молекулярно-масовим розподілом.
Значення стеричного фактора (гнучкості) макромолекули полиакрилонитрила = 2,5-3,2, а довжина сегмента Куна 3,17 нм [5, С. 150].
2. Властивості полиакрилонитрила
Поліакрилонітрил при нагріванні змінює свій колір, причому цей процес завжди супроводжується втратою розчинності. Передбачається, що зміна забарвлення пов'язано з утворенням азометинових містків між сусідніми макромолекулами, чому сприяє сильне тяжіння, що існує між атомом азоту та рухомим атомом водню, що знаходяться в - положенні:
Стабілізація полиакрилонитрила і його сополімерів може бути проведена додаванням N-алкілоксіацетамідов (N, N-диметил, N-етил, N-метил-, N, N-діетілоксіацетамідов). При стабілізації вводять 1-20% одного із зазначених сполук. Для створення тепло- і світлостійкість композиції можна приготувати при використанні стабілізаторів загальної формули R2 NCH2 СH2 CN, наприклад -діметіламінопропіонітріла або -n-бутіламінопропіонітріла [3, C. 354].
Термічний вплив (вище 150 ° С) викликає незворотні зміни в хімічному будову макромолекули полиакрилонитрила, є результатом послідовної взаємодії груп - CN між собою з утворенням циклічних структур. Це властивість полиакрилонитрила використовується при виготовленні вуглецевих волокон (волокон спеціального призначення).
Виробництво вуглецевих волокон на основі ПАН волокон включає дві стадії - термостабілізації і карбонізацію. На стадії термостабілізації ПАН волокна нагрівають приблизно до 180-300 ° С в кисневмісної середовищі, при цьому в структурі полімеру протікає додаткова орієнтація. Утворені одночасно поперечні міжмолекулярні зв'язки між ланцюгами дозволяють уникнути піролізу при більш високій температурі. Досить складний хімізм процесу стабілізації в основному включає в себе циклізація нітрильних груп (C = N) і утворення поперечних (міжмолекулярних) зв'язків ланцюгових молекул, що супроводжується дегидрированием і окисними реакціями. В ході цього процесу лінійний полімер набуває сходову структуру [4, С. 30].
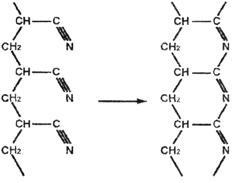
Освіта хромофорних сполучених зв'язків - C = N-, що викликає інтенсивне фарбування полиакрилонитрила в оранжево-коричневий і далі в чорний колір, промотуючих нуклеофільними реагентами; найбільш ефективні карбонові кислоти, феноли, іміди і менш активні аміди, аліфатичні аміни, спирти, альдегіди і кетони (крім ацетону). В інертному атмосфері таке перетворення протікає гладко і аж до 220 ° С не призводить до руйнування основної полімерного ланцюга.
Нагрівання на повітрі призводить до окислювального дегидрированию з утворенням конденсованих нафтірідінових структур і ускладнюється паралельно протікають процесами термоокислительной деструкції полиакрилонитрила.
Продукти термічного перетворення полиакрилонитрила нерозчинні в звичайних для полиакрилонитрила розчинниках і мають виключно високу термостійкість: внесені в полум'я пальника порошок або волокно чорного кольору з термообробленого полиакрилонитрила розпалюються до червоного, але не горять [6, С. 44].
Поліакрилонітрил обмилюється H2 SO4конц. (75-95% -ва) на холоду; утворюється пластівчастий продукт білого кольору з молекулярною масою 62% від початкової, що містить амідні (молярна концентрація до 90%) і імідний ланки:
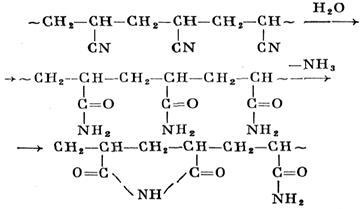
Цей продукт розчинний у воді і слабких розчинах кислот і лугів, але не розчинний у диметилформаміді. Плівки, отримані з 20% -ного водного розчину цього продукту, прозорі і еластичні, але при висушуванні стають крихкими; при 200 ° С вони сильно темніють і при 250-260 ° С руйнуються, що не плавлячи.
Нагрівання полиакрилонитрила в процесі розчинення в H2 SO4 призводить до повного зникнення амідних і імідних груп і утворення карбоксильних груп.
При обробці полиакриламида розчином соди ступінь омилення досягає 30-40%. За деструктивному дії обмилюють агенти можна розташувати в наступний зростаючий ряд: NaOH (1% -ний), НС1, НСООН, Na2 CO3. H2 SO4. H3 PO4. При взаємодії полиакрилонитрила з гідроксиламіном при 50-100 ° С протікає реакція освіти амідоксімних груп з подальшим виділенням аміаку і освітою груп гідроксамової кислоти:
Для реакції застосовується розчин сірчанокислого гидроксиламина і їдкого натру в кількості, достатній для виділення - 99,2% гідроксиламіну. Полімер після реакції містить як групи гідроксамової кислоти, так і не прореагували Нітрільниє групи. Наявність в полімері груп гідроксамової кислоти сприяє кращому фарбуванню поліакрилонітрильного волокна.
Читати далі: Фізичні
Інформація про роботу «Технологія виробництва полиакрилонитрила»