Лопаріт - складне комплексне сировину. Концентрати з-тримають,% (по масі): (Nb, Ta) 2os 8-9; (При відношенні Nb2Os: Ta2Oj «15: і), ТЮ2 32 - 35; (Ce, La.) 203 26 28; СаО 6-8; Na2o 7 - 8, в підпорядкованих кількостях К2О, SrO, оксид Fe І А1, а також ТЮ2 0,2 - 0,7.
Технологія повинна забезпечувати вилучення всіх цінних складових: ніобію, танталу, рідкоземельних металів і титану. Розроблено і використовуються дві технологічні схеми переробки лопарітовим концентратів - хлорне і сернокислотная.
Всі цінні складові лопаріта найбільш просто можна витягти способом хлорування. Сутність його полягає в тому, що компоненти рудного концентрату взаємодіють з газоподібним хлором при 750 - 850 ° С в присутності вугілля або коксу. Відмінності в летючості утворюються хлоридів по-зволяют розділити основні цінні складові кон-рата.
Нижче наведені температури плавлення і кипіння Незнач-яких хлоридів:
Хлорид NbCl, NbOClj А1С13 ТаС15 ТІСІ,
<ПЛ,°С. 204,7 - - 216,5 -23
<пл.°£ ■ • • 'кип> С.
Хлориди ніобію, танталу і титану, що мають порівняно низькі точки кипіння, в процесі хлорування несуться з газами і уловлюються в конденсаційних пристроях; ви - сококіпящіе хлориди рідкісноземельних металів, натрію і кальцію залишаються в хлоратори в формі плаву хлоридів.
Нижче наведені реакції хлорування основних цінних складових лопаріта [4]:
Nb2Os + ЗС12 + 1,5с = 2NbOCl3 + 1,5С02; (2.3)
Nb2Os + 5С12 + 2,5С = 2NbCls + 2,5С02; (2.4)
Ta2Os + 2С12 + 2,5С = 2TaCls + 2,5С02; (2.5)
ТЮ2 + 2С12 + С = ТіС14 + С02; (2.6)
(Ln) 203 + ЗС12 + 1,5с = 2 (Ln) Cl3 + 1,5С02. (2.7)
Одночасно С02 реагує з вуглецем з утворенням
Хлорування оксидів відбувається також за участю оксиду вуглецю, наприклад, по реакціях:
Nb2Os + ЗСО + ЗС12 = 2NbOCl3 + ЗС02; (2.9)
ТІ02 + 2СО + 2С12 = ТіС14 + 2С02. (2.10)
Інші утворюються під час хлорування хлориди: СаС12, NaCl, А1С13, FeCl3, SiCl4.
Реакція хлорування (2.3) - (2.7) протікають зі значи-тельной спадом енергії Гіббса і практично незворотні.
Роль вуглецю полягає не тільки в зв'язуванні кисню в С02, але також в активації процесу хлорування (див. Гл.4).
Хлорування лопарітовим концентрату можна проводити В хлоратора шахтного типу з брикетованої шихтою або в
Хлоратори з сольовим розплавом. Останні мають сущест-ються переваги: виключаються трудомісткі операції при-виготовлених брикетів і їх прожарювання; завдяки ефек-тивному масо - і теплообміну в перемішувати барботують - щим хлором розплаві забезпечується висока швидкість про-процесу і, відповідно, висока питома виробник-ність хлоратора.
При хлоруванні лопарітовим концентрату розплавлений-ва ванна створюється утворюються висококиплячих хлориду-ми натрію, калію, кальцію і рідкоземельних елементів.
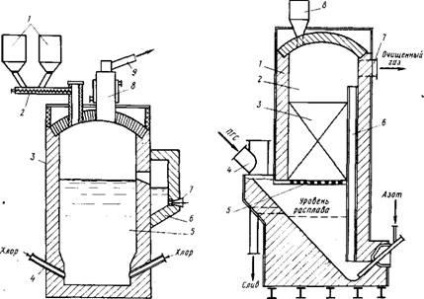
Мал. 24. Хлоратор для хлорування лопарітовим концентрату в сольовому
1 - бункери для концентрату і коксу; 2 - шнековий живильник; 3 - хлоратор, футерований шамотною цеглою; 4 - фурми; 5 - розплав; 6 - копильник; 7 - річка; 8 - охолоджуваний газохід; 9 - патрубок виведення ПГС в систему кон-денсаціі
Ркс. 25. Схема сольового фільтра з аероліфтной циркуляцією розплаву: 1 - корпус, футерований шамотною цеглою; 2 - каплеуловітельная камера; 3 - інертна керамічна насадка; 4 - газохід; 5 - решітка; 6 - аероліфтная труба; 7 - патрубок виведення ПГС; 8 - завантажувальний бункер кус-ков NaCl
Зразковий склад такого розплаву,% LnCi3 55; СаС12 20; NaCl 15, решта - хлориди інших елементів. Температу-ра затвердіння розплаву 520 ° С. Тонкоподрібнений кон-центрат і нафтовий кокс подаються в розплав хлоридів, через який барботируют хлор, що надходить через фурми в нижню частину хлоратора.
Хлоратор є шахту прямокутного січі-ня з висотою рівня розплаву 3,1 - 3,2 м (рис.24). У міру хлорування надлишковий розплав безперервно зливається через перетічними канал в копильник. Нагрівається розплав за допомогою графітових електродів, змонтованих в стінки хлоратора.
Хлорування ведуть при 850 - 900 ° С, середньому утримуючи-ванні концентрату в розплаві 1,5% і вуглецю
5%. У цих умовах питома продуктивність хлоратора по концен-трату - 5 -5,5 т / м2 перетину печі в 1 добу.
Особливістю хлорування в розплаві є преобла-ня змісту СО2 над зі в газовій фазі (відношення СО2: з «16: 1). З цього випливає, що реакції хлорірова-ня оксидів в оасплаве йдуть з утворенням СО2, а реакція будуар (СО2 + з<—-2СО) протекает лишь частично, так как пузырьки со2 быстро удаляются из расплава, не успевая вступить в реакцию с взвешенными частицами кокса.
Відчували різні системи конденсації компонентів парогазової суміші (ПГС). Набула поширення систе-ма, в якій послідовно здійснюється первоначаль-но конденсація твердих хлоридів (NbOCi3, NbCis, TaCls і ін.) В пилових камерах при температурах на виході з ка-мер 200 - 140 ° С, а потім рідких хлоридів (TiCi4, SiCi4) в зрошувальних конденсаторах з зрошенням охолодженим тет - рахлорідом титану.
З метою відокремлення хлоридів заліза і алюмінію і виключним видом-чення їх конденсації разом з хлоридами ніобію і танталу перед пиловими камерами встановлюють сольовий фільтр. Його дія заснована на утворенні FeCi3 і Aici3 з хлориду-ми натрію і калію легкоплавких комплексів типу MeFeCi4 і МеА1С14, термічно стійких і володіють низьким тиску-ням парів рпар при температурах 500 - 600 ° С:
KA1C14 NaAlCl4 KFeCl4 NaFeCl4
ГПЛ, ° С 256 152 249 163
Па 20 13,3 36,3 334
Над сольовими розплавами систем Naa-Fea3-Aici3 і Kci-Feci3-Aici3 тиск парів хлоридів NbOCi3, NbCis, TaCls, TiCi4, SiQ4, високе, тому вони не поглинаються расплавами сольового фільтра.
На рис.25 наведена схема сольового фільтра. Розплав хлоридів в фільтрі циркулює за допомогою аероліфтного ус-тройства.
У фільтр періодично завантажують суміш NaCl + КС1 або відпрацьований електроліт магнієвих електролізерів. У міру накопичення з фільтра зливається розплав, насичений хло-рідамі заліза і алюмінію.
У сольовому фільтрі крім хлоридів заліза і алюмінію уловлюються тверді частинки (механічний винесення з хлору-тора).
Конденсат твердих хлоридів має наступний приблизний склад в перерахунку на оксиди,% (по масі): (Nb, Ta) 2os 51 - 54; ТЮ2 1,0 - 1,8; Fe203 0,40 - 1,4; Si02 0,43 - 1,4; ai2o3 0,64 - 0,8; Tho2
0,1; Ln2o3 0,9; з 0,5 - 2. Частина танталу і ніобію потрапляє в конденсат рідкого TiCl4, де вони знаходяться в розчині і частково у вигляді суспензії. При ректифікації очищення TiCl4 вони залишаються в кубовому ос-татка, з якого додатково витягуються.
Таким чином, в результаті хлорування лопаріта по-лучают три продукти: плав, що містить хлориди РЗМ, кон-денсат хлоридів танталу і ніобію і технічний тетрахло - рід титану.
Для отримання суміші оксидів танталу і ніобію конденсат хлоридів піддають гидролитическому розкладанню:
2NbOCl3 + О + 3) Н20 = NbjOj • хН2о + 6НС1; (2.11)
2TaCls + (х + 5) Н20 = Ta20s'xH20 + 10НС1. (2.12)
У кислий розчин переходить велика частина домішок же-леза, алюмінію і частково титану. Отримана суміш гідро - Ксідо, що містить до 90% (Nb, Ta) 2os (в прожареному про-продукті), надходить на очистку і поділ танталу і ні-обія. Інший шлях переробки конденсату, що містить NbOCi3, NbCls, TaCis, хлориди заліза, алюмінію і ін. За-ключается В отриманні суміші ЧИСТИХ пентахлорид NbClj і ТаС15, які потім можна розділити методом ректіфі-кации.
Хлорне технологія переробки лопаріта забезпечує вилучення 93 - 94% ніобію і 86 - 88% танталу в тех-етичні оксиди, 96,5 - 97% титану в технічний тетрахло - рід, витяг 95,5 - 96% рідкоземельних металів в плав хлоридів.
Сірчанокислотний спосіб заснований на розкладанні лопаріта - вого концентрату сірчаної кислотою і поділі цінних со-складових з використанням відмінностей в розчинності подвійних сульфатів титану, ніобію і танталу, редкоземель-них елементів з сульфатами лужних металів або амонію.
Концентрат розкладають (сульфатізірующий) 95% -ної сірчаної кислотою при 150 - 250 ° С. Витрата кислоти - 2,78 т на 1 т тонкоизмельченного концентрату. Додавання сульфату аммо-ня (0,2 т на 1 т концентрату) до сірчаної кислоти запобігання-обертає спікання реагує маси і підвищує витяг в розчин ніобію і танталу. Повне розкладання концентрату досягається за 20 - 30 хв. До кінця розкладання отримують напівсуху масу. Основні реакції, що протікають при розлив-жении:
ТЮ2 + СаО + 3H2so4 = CaTi (so4) 3 + ЗН2О; (2.13)
4ТЮ2 + Ln2Oj + 11H2S04 = Ln2 (S04) X
X 4Ti (S04) 2 + 11H20. (2.14)
Ніобій і тантал в присутності великої кількості титану входять до складу подвійних сульфатів титану у вигляді ізоморфний-ної домішки. Продукт сульфатізаціі витравлюють водою. У твердій фазі залишається переважна частина РЗЕ в формі мало-розчинних подвійних сульфатів Na2so4 • Ln2 (so4) 3 • 2Н2О і їх изоморфной суміші з CaS04. У розчин переходять титан (у вигляді Ti0S04), ніобій і тантал (ймовірно, в формі сульфа-тов 32o3 (so4) 2.
Для відділення титану від ніобію і танталу використовують осадження сульфатом амонію малорастворимой подвійної солі (NH ^ TicKso ^ j • Н2О. При сумарною концентрації H2so4 + + (NH4) 2so4 400-600 г / л розчинність солі дорівнює 2,5 5г / л. в осад виділяється 70 - 80% титану від його содер-жания в розчині. Подвійний сульфат титану використовують як ефективний дубитель шкіри. Термічним його розкладанням можна отримати технічний діоксид титану.
З розчину, в якому залишаються ніобій, тантал і частина титану, витягають ніобій і тантал екстракцією (див. Нижче).
Сірчанокислотний спосіб не забезпечує настільки чіткого поділу всіх цінних складових лопаріта, яке дос-Тігана під час хлорування. Однак позитивної його сто-роною є використання дешевого реагенту і кращі санітарні умови праці.
Витяг ніобію, танталу і РЗМ в кінцеві продукти приблизно таке ж, як в хлорному спосббе, витяг ти-тана нижче (
70%). Його можна підвищити додатковим через потягом титану з рафінат після екстракційного через потягу ніобію і танталу.