Метод відштовхування електронних пар
Метод ВС лежить в основі визначення кутів між зв'язками і їх спотворень під впливом несвязивающіх електронних пар. При цьому виходять з того, що має місце відштовхування електронних пар валентної оболонки (ОЕПВО).
Фізичні основи методу ОЕПВО, запропонованого Гіллеспі і Найхолмом, визначаються принципом Паулі: з урахуванням того, що атомна орбіталь займає певну область простору, можна стверджувати, що в цій області може знаходитися тільки одна електронна пара, інші будуть виштовхувати з цієї області.
Таким чином, головне положення методу ОЕПВО полягає в тому, що електронні пари валентної оболонки атома (в молекулі) взаємно відштовхуються і розташовуються навколо атома таким чином (під такими кутами), щоб це відштовхування було мінімальним.
Позначимо молекулу (або її фрагмент) АВn. де А - центральний атом, В - бічний атом (ліганд), n - число атомів В навколо А. Електронні пари навколо атома А можуть бути зв'язують (приєднують атом В) і несвязивающімі або неподіленими (позначимо їх Х і Е, відповідно). Тоді електронні пари атома А в молекулі АВn (з урахуванням несвязивающіх пар) можна позначити як АХn Em При етомобщее число електронних пар одно n + m. У формулі враховуються тільки ті електронні пари, які перебувають в s - положенні до атома А, тобто їх електронні щільності спрямовані по осі зв'язку з атомами В; всі Е-пари також знаходяться в s-положенні. У методі ОЕПВО з урахуванням гібридизації беруть, що всі електронні пари займають приблизно однакове простір. Для простоти вважають, що вони являють собою сфери однакового радіуса. Очевидно, що якщо розміри всіх електронних пар навколо атома А однакові, то вони утворюють правильні фігури.
Метод ОЕПВО визначає зміни форм молекул і спотворення кутів між зв'язками в порівнянні з ідеальними за рахунок неподіленого електронних пар і кратних зв'язків, а також взаємне розташування нерівноцінних атомів і електронних пар. Для того щоб скористатися цим методом, потрібно перш за все визначити:
1) загальне число електронних пар атома А;
2) з цього числа - форму правильної фігури, утвореної електронними хмарами;
3) далі необхідно встановити скільки з них зв'язують, несвязивающіх і кратних. Найзручніше це можна зробити, скориставшись схемою ВС даної молекули;
4) Після цього можна визначити геометрію молекули.
Перелічимо основні положеніяметода ОЕПВО.
1. Несвязивающіе електронні пари відштовхують сильніше, ніж зв'язують, тому вони спотворюють форму молекули. Якщо, наприклад, за складом електронних пар ми маємо молекули типу АХ3 (NO3 -) і ах2 Е (NO2 -), то їх форма відповідно до правила 1 буде наступною
(Рис. 3.15):
Мал. 4.15.Форма молекул при гібридизації sp 2
2. Так як несвязивающіе електронні пари відштовхуються сильніше, то при наявності декількох несвязивающіх електронних пар вони розташовуються на максимальному видаленні один від одного. Наприклад, для молекул типу АВ4 з електронними парами типу АХ4 Е2 (ХеF4)
(Рис. 3.16, а) буде вигідна плоскоквадратная форма (sp 3 d 2-гібридизація), а для молекул типу АВ2 з електронними парами ах2 Е3 (наприклад, ХеF2) - лінійна (рис. 3.16, б).
В останньому випадку кути між парами в екваторіальній площині більше, ніж між нею і віссю (120 і 90 0), тому взаємне відштовхування Е-Е в площині буде менше.
3. Чим більше електронний торгівельний кінцевих атомів (В), тим сильніше вони відштовхуються несвязивающей електронної парою, тобто кути ВАВ менше. Наприклад, молекули з електронними парами типу АХ3 Е (NH3 і NF3) мають кути: Ð HNH = 107 ° і Ð FNF = 102 °, що відповідає ЕО (Н) = 2,1 і ЕО (F) = 4.
E E 5s 5p 5d Хе * x x x x E
Мал. 4.16, а. Схема ВС і структурна формула молекули XeF4
E E Е 5s 5p 5d Хе * x x F 2p ½ E ¾ Хе ¾ E ½ E 2s F F F Рис. 4.16, б. Схема ВС і структурна формула молекули XeF2
4. Кратні зв'язку відштовхують сильніше, ніж ординарні. Наприклад, молекула ХеО3 F2 (тип АВ5. Трігональная Бипирамида, електронні пари АХ5 + 3π) має три атома кисню в площині (кути ОХеО = 120 °), так як у них подвійні зв'язку, а молекула UO2 F5 -3 (тип АВ7 - пентагональними Бипирамида, електронні пари АХ7 + 2π) має лінійне розташування атомів кисню, так як кути FUF = 72 °, тобто менше 90 °.
5. Спотворення кутів між зв'язками під дією неподіленої електронної пари тим більше, чим більше число вільних АТ на валентній оболонці атома і більше її розміри. Наприклад, у однотипних молекул NH3. PH3. AsH3 кут в цьому ряду зменшується зі збільшенням числа валентних АТ (табл. 4.3). Те ж саме можна сказати про молекулах H2 O, H2 S, H2 Se.
Вплив числа валентних АТ на валентний кут
Мал. 4.17. структура молекули
Молекула SOCl2. Беремо атом сірки в збудженому стані, щоб утворити три s-зв'язки з атомами хлору (дві) і кисню (одна). Ще один неспарених електронів йде на освіту p-зв'язку з атомом кисню (рис. 3.18). Кількість електронних пар, які перебувають в s- положенні, з урахуванням несвязивающей 3s-АТ, у атома сірки - чотири: АХ3 Е + p-зв'язок (sp 3-гібридизація). АХ3 Е дає конфігурацію тетраедра, спотвореного несвязивающей електронної парою Е. відсутність атома на місці Е дає нам замість тетраедра трігональную піраміду
(Табл. 3.4). Всі кути будуть менше тетраедричного (Ð109,28 °), і, крім того, можна передбачити, що кут ClSCl буде менше, ніж ClSO відповідно до правила 4.
Таким чином, метод ОЕПВО може передбачати геометрію молекул. Однак вона правильно робить це не у всіх випадках. Найбільш прийнятна ця теорія до нековалентним з'єднанням s- і р-елементів.
Число локалізованих електронних пар центрального
атома і просторова конфігурація молекул АВn
s- електронні пари атома А
Склад і форма молекули і електронні пари
Полярність ковалентного зв'язку. Електричні властивості. Атоми і молекули містять електрично заряджені частинки - електрони (# 275;) і ядра з зарядом + Z. Так як електрони швидко рухаються у відносно великій області близько ядра, то для визначення електричних властивостей атомів і молекул необхідно ввести поняття "центру ваги" або полюса негативного і позитивного електричного заряду. Очевидно, що в атомі вони збігаються і атом неполярний. Такий стан має місце і в деяких молекулах: двоатомних (Е2), а також високосімметрічних багатоатомних (СН4. BF3. SF6 і ін.).
3s 3p 3d S * Е х х х p
Мал. 4.18. Схема ВС і структурна формула
Якщо "центр ваги" негативного і позитивного зарядів не збігається, то молекула полярна і утворює диполь, який характеризується дипольним моментом, абсолютна величина якого
де # 948; - заряд полюса, l - відстань між полюсами, стрілка вказує на те, що диполь - величина векторна.
Величина m вимірюється в системі СІ в Кл · м (кулон на метр). Типові значення можна оцінити по заряду електрона ( »10 - 19 Кл) і довжині межатомного відстані (" 10 - 10 м), тобто вони становлять »10 - 29 Кл · м. Для зручності використовується спеціальна одиниця вимірювання дипольного моменту - дебай (D):
Для характеристики диполя, крім його величини і напрямки, використовують величини ефективного заряду # 948; еф і довжину диполя l. Ці величини в тій чи іншій мірі відрізняються від ступеня окислення і довжини зв'язку, відповідно.
Дипольні моменти молекул, що містять полярні зв'язку, визначаються як сума дипольних моментів зв'язків. При цьому проводиться векторне складання диполів на зв'язках (в хімічній літературі за позитивний напрямок диполя приймається напрямок від "+" до "-"). Сума двох диполів виходить як діагональ паралелепіпеда, побудованого на них. Наприклад, для кутовий молекули АВ2:
Якщо диполів більше 2-х, то їх складають послідовно попарно. Очевидно, що для лінійних молекул АВ2. плоских трикутних - АВ3. тетраедричних і квадратних - АВ4. тригонально-бипирамидальний - АВ5. октаедричних - АВ6. дипольний момент дорівнює нулю.
У таблиці 4.5 наведені дипольні моменти деяких речовин, а в таблиці 4.6 - ефективні заряди (в одиницях заряду електрона) на атомах в деяких з'єднаннях.
Ефективні заряди, що характеризують ассиметрию електронної хмари, умовні, так як електронне хмара делокалізованних і його не можна "розділити" між ядрами; так що величини зарядів залежать від методу визначення.
Дипольні моменти деяких молекул
В якості запобіжного полярності зв'язку або молекули часто використовують величину ступеня ионности (i) або ковалентності (К).
Так, якщо в молекулі HCl qCl = 0,2qe. а wCl = -1, то i = 0,2, тобто ступінь ионности дорівнює 20%, а ступінь ковалентності - 80%.
Величина ионности зв'язку А-В може бути оцінена також по різниці електронегативності атомів (DЕО) (табл. 4.7,
Мал. 4.19).
Малюнок 4.19 наближено виражає встановлену Полингом залежність між ступенем ионности зв'язку і різницею електроотріцательностей елементів. З малюнка слід, що тільки для фторидів лужних і лужно-земельних металів зв'язок можна вважати близькою до іонної.
Так як для фторидів лужних металів близько 3, то
i »90%, що близько до чисто іонного зв'язку.
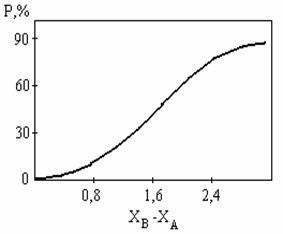
Мал. 4.19. Залежність ступеня ионности зв'язку від різниці
електроотріцательностей елементів (по Полингу)
Залежність ступеня ионности від різниці
Ця залежність нелінійна, а самі цифри вельми наближені, як і всі залежності, пов'язані з електронегативні елемента.
Так як величини # 967; і i є важливими характеристиками атомів і хімічних зв'язків в сполуках, то корисно також мати математичну формулу зв'язку між ними:
Ця формула не претендує на точність, як і самі величини ионности і електронегативності, але практично корисна при порівнянні ионности хімічних зв'язків.
Скориставшись пошуком можна знайти потрібну інформацію на сайті.
Генерація сторінки за: 0.04 сек.