Хімічна і електрохімічна корозія. Анодний і катодний процеси при електрохімічної корозії. Електрохімічна корозія з водневою і кисневою деполяризацією. Корозія при контакті різнорідних металів. Основні способи захисту металевих конструкцій від корозії. Металеві покриття анодні і катодні. Електрохімічні способи захисту-протекторна, катодний захист.
Корозія - мимовільне небажане руйнування металу в результаті його взаємодії з навколишнім середовищем.
При корозії метал (відновник) окислюється під дією окислювача, що є компонентом середовища, тобто корозія - окислювально-відновний процес.
За механізмом протікання корозійного процесу виділяють хімічну і електрохімічну до оррозію.
Хімічна корозія проходить в середовищі неелектроліту шляхом безпосереднього переходу електронів від атомів металу до окислювача. Найбільш поширені види хімічної корозії - газова корозія і корозія в середовищі неелектроліту (бензину, нафти, органічних розчинників).
Газова корозія спостерігається в агресивних газах (хлор, кисні, оксиди сірки, азоту) і парах без конденсації вологи на поверхні металу, зазвичай при високих температурах. Цьому виду корозії піддається ріжучий інструмент, лопатки газових турбін, деталі реактивних двигунів.
Приклад корозії в середовищі неелектроліту - корозія в рідкому паливі (руйнування деталей двигунів внутрішнього згоряння і т.д.).
Електрохімічна корозія проходить в середовищі електроліту, її відмінність - поділ в просторі процесів окислення і відновлення. Цей тип корозії більш поширений, їй піддаються металеві конструкції в грунтових, річкових і морських водах, в розчинах солей, кислот, лугів, в атмосфері під адсорбованими плівками вологи і т.д. Електрохімічна корозія здійснюється при наявності різниці потенціалів ділянок металевої поверхні.
Основні причини електрохімічної корозії (виникнення різниці потенціалів)
контакт різнорідних металів,
мікронапруги в металевому виробі,
неоднорідність механічної або термічної обробки металевої поверхні,
наявність неметалічних включень і забруднень (графіту, карбідів, плям фарби на поверхні і т.д.),
різницю температур ділянок металевої поверхні.
Здатність металу чинити опір корозійного впливу середовища називають корозійну стійкість. Корозійну стійкість визначають якісно і кількісно - швидкістю корозії в даних умовах, групою або балом стійкості за прийнятою шкалою. Метали, що володіють високу корозійну стійкість, називають корозійно стійкими.
Анодний і катодний процеси при електрохімічної корозії
При електрохімічної корозії виділяють два взаємопов'язані процеси: анодний і катодний.
Анодний процес - окислення металу, проходить на ділянках виробів з меншим потенціалом в даному середовищі. Анодні ділянки руйнуються.
Катодний процес - відновлення окислювача, що знаходиться в розчині або розплаві електроліту, відбувається на ділянках виробів з більшим потенціалом в даному середовищі. Катодні ділянки хімічно не змінюються. Вони служать провідниками електронів від анодних ділянок до окислювача, ніж посилюють корозію анодних ділянок. Більш детально це буде розглянуто далі на конкретних прикладах.
Окислювачі при корозії прийнято називати деполяризаторами. Корозію за участю найбільш поширених окислювачів - розчиненого кисню і іонів водню (кислоти або води) відповідно називають корозією з кисневою і водневою деполяризацією. Рівняння катодних процесів наведені в таблиці.
Рівняння катодного процесу при корозії
Окисні властивості кисню вище окислювальних властивостей іона водню (або води). У присутності кисню в розчині корозія необов'язково буде проходити за рахунок кисневої деполяризації, так як концентрація розчиненого кисню, як правило, невелика. Встановлено, що при рН7, тобто в нейтральних і лужних розчинах, процес зазвичай протікає з кисневою деполяризацією - рівняння (4), в кислих середовищах - переважно з водневою деполяризацією - рівняння (1).
Корозія, як і будь-який окислювально-відновний процес, може здійснюватися тільки за умови, що потенціал окислювача більше потенціалу відновника (металу анодних ділянок).
Корозія при контакті різнорідних металів
Один з поширених випадків електрохімічної корозії - процеси, що відбуваються при наявності контакту двох металів, що знаходяться в розчині електроліту. Таку пару металів (М1 і М2) називають гальванопари і позначають М1 / М2.
Спрощений опис корозійного процесу за участю гальванопар доцільно виконувати в такій послідовності.
Виписати значення потенціалів металів в даному середовищі, визначити анод (метал - з меншим значенням потенціалу) і катод (метал - з більшим значенням потенціалу).
Виписати значення потенціалу можливого окислювача (деполяризатора).
Оцінити можливість процесу порівнянням потенціалів окислювача і відновника.
Написати рівняння напівреакцій:
анодної - окислення матеріалу анода;
катодного - відновлення окислювача.
Підсумувати рівняння напівреакцій, написати іонну і молекулярну рівняння окисно-відновної реакції, що протікає при гальванокоррозіі.
казать на умовній схемі гальванопари напрямок переміщення електронів.
Розгляньте процес корозії лудженого (покритого оловом) заліза за умови порушення цілісності покриття в кислому середовищі за відсутності розчиненого кисню.
За умови порушення цілісності покриття утворюється гальванопари, її умовна схема
Значення потенціалів металів
Fe - анод гальванопари (А) - відновник, окислюється;
Sn - катод гальванопари (К).
Можливий окислювач - іони водню кислоти,
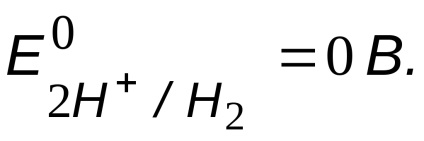
Порівняння потенціалів окислювача і відновника
, тобто корозія заліза можлива.
A: Fe - 2ē = Fe 2+ - окислення
K (Sn): 2Н + + 2ē = Н2 - відновлення
Іонну і молекулярну рівняння:
Fe + 2Н + = Fe 2+ + Н2
Напрямок переміщення електронів на умовній схемі гальванопари (від ділянки з меншим потенціалом до ділянки з більшим потенціалом):
У гальванопари олово-залізо в кислому середовищі руйнується залізо, на олові виділяється водень.
Розгляньте процес корозії з кисневою деполяризацією у вологому повітрі гальванопари Mg / Fe.
Умовна схема гальванопари
Значення потенціалів металів
.
Mg - анод гальванопари (А) - відновник, окислюється.
Fe - катод гальванопари (К).
Окислювач при корозії з кисневою деполяризацією - кисень,.
A: 2 Mg + 2H2 O - 2ē = Mg (OH) 2 + 2H + - окислення
K (Fe): 1 O2 + 2H2 O + 4ē = 4OН ¯ - відновлення
2Mg + 4H2 O + O2 + 2H2 O = 2Mg (OH) 2 + 4H + + 4OH ¯
Напрямок переміщення електронів на умовній схемі гальванопари:
При контакті різнорідних металів більш активний метал піддається окисленню, руйнується. Контакт з менш активним металом посилює корозію більш активного металу. Контакт з більш активним металом захищає менш активний метал від корозійного руйнування.
етод захисту металів від корозії
лаки, фарби, емалі, бітум, пластмаси, кераміка, гума, смоли та інші покриття, що наносяться фізичними способами;
оксидні, фосфатні і інші плівки, одержувані обробкою металу хімічними речовинами.
Анодні покриття - покриття вироби більш активним металом, тобто металом з меншим потенціалом в даному середовищі, ніж потенціал покривається металу, приклад - оцинковане залізо.
Катодниепокритія - покриття вироби менш активним металом, тобто металом з більшим потенціалом в даному середовищі, ніж потенціал покривається металу; приклади - меднение, нікелювання стали.
Схеми процесів, що відбуваються в порах або при порушенні суцільності металевих покриттів, наведені на малюнку.