Білки м'язової тканини
Білковий склад м'язової тканини вельми складний. Вже з давніх пір він вивчається багатьма вченими. Основоположник вітчизняної біохімії А. Я. Данилевський, досліджуючи білки м'язової тканини, дав правильне уявлення про фізіологічну роль низки білків і про значення скорочувального білка міозину, що міститься в миофибриллах.
Надалі миозин досліджували В. А. Енгельгардт, І. І. Іванов та інші радянські вчені. Великий внесок у вивчення м'язового скорочення вніс угорський вчений Сцент-Джорді. Інший угорський вчений Штрауб відкрив білок м'язів актину.
Вивчення м'язової тканини слід починати з білків, так як на їх частку припадає близько 80% сухого залишку м'язової тканини. Відповідно до морфологічної структурою м'язового волокна білки розподіляються наступним чином:
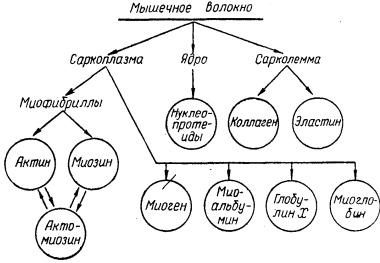
З наведеної схеми видно, що білковий склад м'язової тканини дуже різноманітний. У саркоплазме міститься чотири білка: міоген, Міоальбумін, глобулін X і міоглобін. У миофибриллах міститься комплекс, що складається з актину і міозину, званий актомиозином. Всі білки саркоплазми називаються внутрішньоклітинними, а білки сарколеми - позаклітинними, В ядрах містяться нуклеопротеїни, в антисарколемальних - колаген та еластин. Якщо врахувати, що в м'язовій тканині, крім того, міститься ще значна кількість різних ферментів і кожен з них є особливим білком, то білковий склад м'язової тканини виявляється ще більш складним.
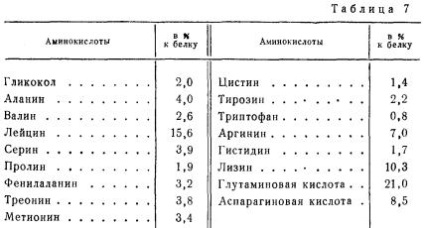
Основним білком м'язової тканини є міозин. Він становить майже половину всіх білків м'язової тканини, причому він зустрічається в м'язах всіх ссавців, птахів і риб. За харчовою цінністю він є повноцінним білком. У табл. 7 наведено амінокислотний склад міозину бика.
Міозин був детально вивчений радянськими биохимиками, які виявили, що він є не тільки структурним білком м'язової тканини, т. Е. Білком, які беруть участь в побудові клітини, але і ферментом - аденозінтріфосфатаза, що каталізує реакцію гідролізу АТФ. При цьому утворюються АДФ (аденозінді-фосфорна кислота) і фосфорна кислота і виділяється велика кількість енергії, використовуваної при м'язовій роботі.
Міозин отриманий в чистому кристалічному вигляді. Молекулярний вага його дуже великий, приблизно 1,5 млн. Кристалічний міозин при повній відсутності солей прекрасно розчинний у воді. Ho досить додати до води незначна кількість будь-якої солі, наприклад хлористого натрію, як він повністю втрачає здатність розчинятися і розчинення настає вже при концентрації хлористого натрію близько 1%. Однак по відношенню до солей, наприклад до сірчанокислого амонію, міозин поводиться як типовий глобулін.
Під час вилучення білків м'яса водою міозин не переходить в розчин. При обробці м'яса сольовими розчинами він виявляється в сольовому витягу. При розведенні водою сольового розчину міозину зменшується концентрація солі і міозин починає випадати в осад. Міозин висаліваются при повному насиченні хлористим натрієм і сірчанокислим магнієм (висолювання виробляють кристалічною сіллю, інакше добитися повного насичення неможливо).
Ізоелектрична точка міозину знаходиться при pH 5,4-5,5.
Міозин має властивість вступати в особливі зв'язки з різними речовинами, в першу чергу з білками, з утворенням комплексів. Особливу роль в діяльності м'язів грає комплекс міозину з актином - актоміозін.
Актин і актоміозін
У м'язової тканини міститься близько 20% глобуліну X від усієї кількості білка. Він є типовим глобуліном, т. Е. Не розчиняється у воді, але розчиняється в сольових розчинах середньої концентрації; осідає з розчинів при половині насичення сірчанокислим амонієм (1 об'єм розчину білка і 1 об'єм насиченого розчину сірчанокислого амонію), хлористим натрієм при повному насиченні.
У м'язової тканини міститься близько 20% Міогена від усієї кількості білка. Його не можна віднести до типових альбуміну або глобулинам, так як він розчиняється в воді, недостатньо висаліваются хлористим натрієм і сірчанокислим магнієм при насиченні (кристалічною сіллю), в той же час осідає сірчанокислим амонієм при 2/3 насичення (1 обсяг білкового розчину і 2 обсягу насиченого розчину сірчанокислого амонію). Цей білок був отриманий в кристалічному вигляді. Молекулярний вага Міогена 150 000.
В. А. Енгельгардт виявив у Міогена здатність каталізувати одну з найважливіших реакцій, що протікають в процесі гліколізу м'язової тканини. Цим відкриттям вперше було показано, що ферментативної активністю можуть володіти структурні білки, т. Е. Білки, які беруть участь в побудові тканин.
У м'язової тканини міститься близько 1-2% Міоальбумін від усієї кількості білка. Він є типовим альбуміном, т. Е. Розчиняється у воді, не осідає хлористим натрієм при насиченні, але осідає сірчанокислим амонієм.
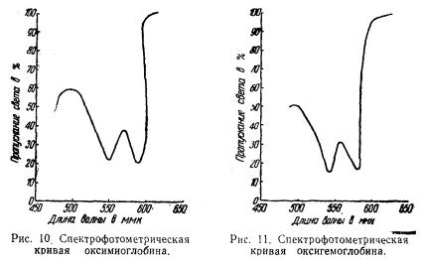
Поглинання світла пофарбованими речовинами можна визначити кількісно спектрофотометром. Отримані результати прийнято виражати графічно. В цьому випадку по осі абсцис відкладають довжину хвилі світла, а по осі ординат - кількість світла в процентах, що пройшло через розчин. Чим менше пройшло світла, тим більше поглинулося його пофарбованим речовиною. Повний пропускання світла розчином приймається за 100%.
На рис. 10 показано поглинання (абсорбція) світла розчином оксимиоглобин; з нього видно, що оксимиоглобин має дві яскраво виражені характерні смуги поглинання у видимій області спектра, т. е. дві ділянки, в яких він найменше пропускає світла і, отже, найбільше поглинає світла. Максимуми цих ділянок знаходяться при двох довжинах хвиль; # 955; 585 ммк і # 955; 545 ммк,
На рис. 11 показана для порівняння спектрофотометрична крива оксигемоглобина.
Міоглобін має більшу здатність зв'язуватися з киснем, ніж гемоглобін крові. За допомогою міоглобіну м'язова тканина забезпечується киснем. У працюючих м'язах міоглобіну міститься більше, так як в них окислення протікає інтенсивніше. Відомо, що м'язи ніг сильніше забарвлені, ніж спинна м'яз; м'язи працюють волів пофарбовані також сильніше, ніж непрацюючих тварин. Особливо це помітно у птахів, грудні м'язи яких, будучи неробочими, майже не пофарбовані.
Колаген і еластин
Колаген і еластин - сполучнотканинні білки нерозчинні у воді і сольових розчинах. Вони утворюють сарколемму - найтоншу оболонку м'язового волокна.
Нуклеопротеїди - білки, складові клітинне ядро. Характерною особливістю їх є здатність розчинятися в розчинах слабких лугів. Це пояснюється тим, що в їх молекулі міститься простетичної група, що має кислотні властивості.
Поділ білків м'язової тканини
При обробці м'язової тканини сольовими розчинами середньої концентрації її білки можна розділити на білки строми і білки плазми. Під стромой розуміють не розчинний в сольовому розчині структурну основу м'язової тканини, яка складається головним чином з білків сарколеми (див. Схему).

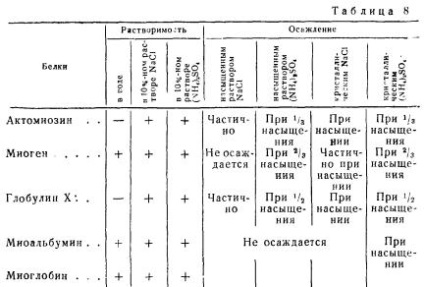
Розчинність внутрішньоклітинних білків м'язової тканини різна. Наприклад, актоміозін і глобулін X не розчиняються у воді і легше осідають з сольових розчинів сірчанокислим амонієм і хлористим натрієм, ніж міоген. Міоген розчиняється в воді подібно Міоальбумін, але відрізняється від нього по висаліваемості.
Розчинність білків м'язової тканини в розчинах солей при нейтральній реакції і їх осаждаемость наведені в табл. 8.
При засолі, варінні і інших видах технологічної обробки м'яса відбувається втрата білкових речовин. Величини втрат білків обумовлені різними розчинністю і осаждаемастью їх.
Знаючи властивості білків, можна підібрати такі умови, при яких втрати будуть найменшими. Тому на вивчення зазначених властивостей білків повинно бути звернуто особливу увагу.