Основні ефекторні молекули адаптивного гуморального імунно-го відповіді - молекули імуноглобулінів.
Структура і функція основних класів імуноглобулінів
Структура імуноглобулінів стала відома завдяки роботам Р. Портера і Г. Едельман. Р. Портер обробив препарат 1§С кролика ферментом папаїном. В результаті були отримані три фрагмента, два з яких мали однакову молекулярну масу (45 кДа) і пов'язували антиген. Вони були названі РаЬ (англ. РДА $ теп1 апХщеп-Итйт *?). Третій фрагмент (55 кДа) з постійною структурою був схильний легко кристалізуватися і був названий Рс (англ. РДА ^ Тептя спвИІгаИе). При дей-наслідком пепсину молекула імуноглобуліну розщеплюється в іншому місці з утворенням двох фрагментів: Рс-фрагмента і фрагмента (Ра') 2, спосіб-ного пов'язувати дві молекули антигену.
Г. Едельман, обробивши молекули антитіл меркаптоетанолом, віднов-встановлюються дисульфідні зв'язки, викликав дисоціацію цих молекул на окремі білкові ланцюги. На підставі цих робіт була запропонована принципова схема будови імуноглобулінів (рис. 4-1).
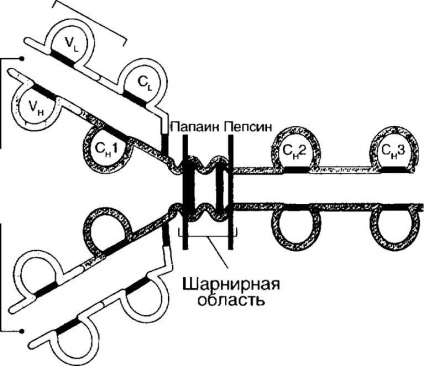
У людини виділяють п'ять класів імуноглобулінів: 1§М, 1§С, 1А, 1% 0 і 1§Е. Імуноглобуліни різних класів мають подібний план будови. Структура імуноглобулінів представлена на рис. 4-1.
Молекула імуноглобуліну складається з чотирьох поліпептидних ланцюгів: двох важких (Н - кеалу) ланцюгів з молекулярною масою 100-120 кДа і двох легких (Ь - Іф1) ланцюгів з молекулярною масою 50-60 кДа. Ці ланцюги об'єднані в молекулу за рахунок ковалентних межцепочечних дісуль- фідних зв'язків (-3-3-). Кожна ланцюг включає варіабельні (Уьі Ун - УАПА) домени, що визначають специфічність молекули іммуноглобу-лина і константні (С - соп5 ^ ап ^) домени. Ь-ланцюг має один констант-ний ділянку (С, -домен). Н-ланцюг містить три константних домену: СН1, СН2, СН3. Між СН1 і СН2 розташована шарнірна область, що складається з гомологічних ділянок, які включають приблизно 110 залишків ами-нокіслот. Вуглеводні компоненти приєднуються більшою мірою до доменів СН2 і забезпечують ряд біологічних властивостей молекул имму-ноглобулінов (приєднання до Рс-рецепторів, до лектинів). Основні елементи домену - два антипаралельних р-складчастих шару, соеди-наних однією або декількома дисульфідними зв'язками. Ця структура иммуноглобулинового домену з'явилася на ранніх етапах еволюції і стала структурним елементом різних рецепторів, об'єднаних в суперсімейство імуноглобулінів (ТСК, молекули МНС, молекули адге-зії, Рс-рецептори і ін.).
При розгляді молекули імуноглобуліну в якості антигену можна виділити наступні антигенні детермінанти:
* Ізотипи - детермінанти, що визначають структурні особливості константних областей важких ланцюгів (ізотип визначається типом важких ланцюгів). Ізотипи однакові у всіх особин даного виду;
* Аллотипи - індивідуальні алельних варіанти іммуноглобулі-нів в межах одного изотипа, обумовлені варіабельністю кон-тну доменів або каркасних ділянок У-доменів;
* Ідіотипи - антигенні детермінанти, локалізовані в вариа-бельной доменах, що визначають специфічність молекули антитіла.
Антигензв'язуючих центр розташовується в N-кінцевих доменах обох ланцюгів імуноглобулінів. Він утворений Уь- і V -доменамі і володіє індивідуальною специфічністю. Усередині варіабельних доменів виокрем-ляють гіперваріабельні області СОК (англ. Сотр1етеп1агу Ве1егт \ п \ п% Ке $ ЮП $): СБК1, СБК2, СЕКЗ. Саме ці послідовності комплемен-тарно взаємодіють з антигеном. Імуноглобуліни пов'язують различ-ні антигени: пептиди, полісахариди, стероїдні молекули і нативні антигени, які не пройшли попередньої обробки. У молекули моно-мірного імуноглобуліну є два активних центру, що зв'язують анти-гени.
Силу зв'язування одного епітопи з одним активним центром имму-ноглобуліна називають аффинностью. Між антигеном і антитілом утворюються численні Нековалентні зв'язку: водневі, гідро-ФОБН, електростатичні взаємодії, ван-дер-валльсови сили. Сумарну силу взаємодії цільної молекули антитіла з усіма антигенними епітопами називають авідності. Консервативні участ-ки (так звані каркасні) У-області молекули імуноглобуліну можуть зв'язувати іони металів, суперантігени, володіти ферментатів-ної активністю.
Імуноглобуліни існують в організмі:
* В розчинній формі в крові та інших біологічних рідинах;
* В складі імунних комплексів (антиген-антитіло);
* В структурі ТСК;
* На поверхні клітин (макрофагів, нейтрофілів і ін.), Фіксований-них на Рс-рецепторах.
Основні характеристики імуноглобулінів різних класів представ-лені в табл. 4-1.
1§М. Молекула 1§М має велику молекулярну масу 970 кДа і поетів-тому погано проникає в тканини. 1§М складається з п'яти мономерів, об'єднаний-них в єдину пентамерную молекулу дисульфідними зв'язками і ланцюгом (рис. 4-2). До складу | і-ланцюга входять чотири З-домену.
Крім пентамер, 1М існує також в мономерной формі на мем-брані В-лімфоцитів в складі ТСК (див. Рис. 3-20).
У процесі імунної відповіді першими виробляються 1§М-антитіла (див. Рис. 4-5). 1§М, зв'язавшись з антигеном, зазнає конформаційні-ні зміни, після чого набуває найбільшу здатність зв'язок-вать і активувати білки системи комплементу.
Основна фізіологічний-ська функція 1М - нейтралізація патогенів (переважно вірусів) в кров'яному руслі.
1С. Імуноглобуліни цього изотипа складають більшість антитіл при вторинному імунній відповіді. 1§С вільно проникає в тканини, а також є єдиним імуноглобуліном, що проходить через плацентар-ний бар'єр. Транспорт через плаценту не є пасивним і відбувається за участю неонатального Рс-рецептора (РсКп) для 1§С. Характеристика РсКп представлена в розділі 3.1. Головна функція РсКп полягає в захищені 1§С від катаболізму після його інтерналізації. Такий меха-нізм забезпечує транспорт 1§С через епітеліальний і ендотеліальні бар'єри, які беруть участь у передачі 1§С від матері до плоду. Виділяють чотири підкласу 1§С: 1С1, 1С2, 1 # СЗ, 1§С4; відмінності в їх властивостях представ
лени в табл. 4-1.1§С1 і 1§СЗ активують комплемент, фагоцити і клітини кілери. 1§С2 і 1§С4 беруть участь в прямій нейтралізації патогенів.
ЦА. Виділяють два підкласу 1§А. 1 ^ А1 циркулює в крові і спо-собствует нейтралізації патогенів, що потрапили в кровотік. Однак 1А1 чутливий до дії бактеріальних протеаз, тому грає незначну тільну роль в нейтралізації збудників. 1§А2 локалізується в секретах слизових оболонок і бере участь в нейтралізації патогенів, що проникають в організм цим шляхом. Димери 1А секретируются плазматичними клітинами неінкапсулірованние лімфоїдної тканини слизових оболонок, наприклад, в Ьатта ргорпа кишечника. Потім вони зв'язуються з поліімму- ноглобуліновим рецептором на базолатеральной поверхні Епітеліаль-них клітин і шляхом ендоцитозу поглинаються цими клітинами. У спеці-ний везикули цей комплекс транспортується через клітку і виділяється в складі слизу. Секреторний компонент захищає молекулу 1А від дії протеолітичних ферментів (рис. 4-3).
1§А бере участь у формуванні першої лінії захисту слизових обо-лочек. Він не активує комплемент, не володіє бактерицидною актив
Структура секреторного 1дА
ністю, але відіграє важливу роль в нейтралізації бактеріальних токсинів. 1§А міститься в молозиві і забезпечує імунний захист немовлят-них на рівні слизових оболонок.
1§0 - трансмембранний рецептор В-лімфоцитів, функції його не відомі.
18Е зв'язуються з базофілами, огрядними клітинами через РсеК1 і викли-вают сенсибілізацію клітин слизових оболонок, що призводить до роз-витку алергічних реакцій.
1§С плода і новонароджених надходить до них від матері і зникає із сироватки крові дитини до 6-8 міс. В цей час імунна система дитини починає синтезувати 1§М і 1§А. У віці 1 року рівень власних 1М в крові дитини практично досягає рівня дорослої людини, 1С - 75%, 1§А - 25% (рис. 4-4).
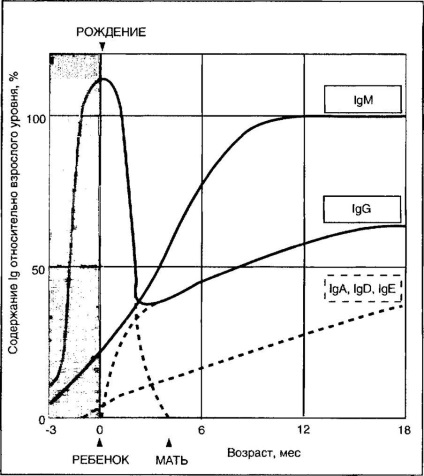
Мал. 4-4. Зміна з віком вмісту сироваткових імуноглобулінів у челове-ка (за даними НоЬЬз 1П. 1969).
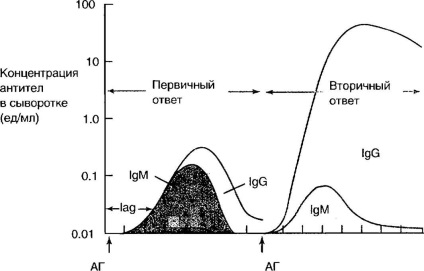
На рис. 4-5 представлена динаміка вироблення імуноглобулінів раз-них класів при первинному і повторному введенні антигену. При привчає-ном імунній відповіді основна маса антитіл представлена 1М. При повторному попаданні антигену в організм кількість 1§М не змінюється, переважаючим класом імуноглобулінів стає 1§С. Афінність антитіл при цьому значно зростає, вони з'являються швидше і досягнень-гают високих концентрацій, зберігаються протягом більш тривалого часу.
Механізми захисту від патогенів, опосередковувані антитілами, можуть здійсню-ществляться за рахунок різних функцій цих молекул.
• антігенспеціфіческую функція антитіл. В результаті пов'язуючи-ня патогена з активним центром антитіла відбувається нейтрализа-ція патогенів та утруднюється їх проникнення в клітини організму. Це стосується в першу чергу до 1М, які беруть участь в зв'язуванні і нейтралізації токсинів збудників дифтерії і правця, а також багатьох вірусів. Після нейтралізації патогени втрачають спосіб-ність зв'язуватися з клітинами-мішенями, виводяться з кровотоку і руйнуються макрофагами. Димери 1§А зв'язуються з антигенами в просвіті органів і перешкоджають проникненню патогенів в епіте-лий слизових оболонок.
Час після імунізації
Мал. 4-5. Динаміка вироблення імуноглобулінів при первинної та вторинної імуно-зації.
Антитіла можуть також опсонізовані бактерії і різні клітини мішені, роблячи їх більш доступними для фагоцитозу або антітелоза-вісім клітинної цитотоксичності.
Ефекторні функції антитіл опосредуются Рс-частиною молекули, що взаємодіє з Рс-рецепторами клітин вродженого імуно-тета або з комплементом (рис. 4-6). Серед них виділяють такі функції.
Про Активація комплементу за класичним типом і комплемент- опосередкований лізис клітин-мішеней (рис. 4-6, а), про 1§М, 1§СЗ, 1С1 в комплексі з антигеном взаємодіють з когось компонентами комплементу СзЬ і С4', пов'язаними з еритроцитами. Таким чином, еритроцити приносять імунні комплекси в печінку і селезінку, де вони фагоцитуються і руйнуються макро-фагами.
про Приєднання комплексу «антиген-антитіло» макрофагами і нейтро- филами, експресуючими РСУ-рецептори з подальшою активу-цією фагоцитозу і руйнуванням комплексу (див. рис. 4-6). Антитілозалежна клітинна цитотоксичність (АЗКЦ). МК-клітини, еозинофіли, нейтрофіли і інші клітини експрес-ють РСУК III типу (СБ16). Ці рецептори беруть участь у зв'язуванні ефекторних клітин через молекули 1§С з інфікованими клітинами-мішенями. МК-клітини запускають перфорінгранзімовий механізм цитотоксичности і вбивають клітину-мішень, індукуючи в ній апоптоз (рис. 4-6, с).
- Активація клітин при взаємодії антитіл з Рс-рецепторами мембрани (рис. 4-6, д).
1§Е-опосередкована реакція гіперчувствітелиюсті. Приєднання комплексу антигену (алергену) з 1Е-антитілом через високо-аффінниє рецептори РсеК1 огрядними клітинами і базофілами іні-ціірует дегрануляцию цих клітин і вивільнення вазоактивних медіаторів (гістамін, л ейкотріени Б4, простагландини) (рис. 4-7). Це призводить до розвитку судинних реакцій: розширення судин, підвищення їх проникності, сприяє виникненню набряку і затримки антигену в осередку, перешкоджає його проникненню в кров. Крім того, відбувається інтенсивне скорочення гладкої мускулатури, спазм бронхів і травного тракту.
Зв'язування 1§Е еозинофілами через нізкоаффінние РсеКН інду-цірует освіту в еозинофілів білкових токсинів, які вбивають гельмінтів, розвиваючи 1§Е-опосередковану антителозависимую кле-точну цитотоксичность.
Крім цього, антитіла здатні в деяких випадках розщеплювати антиген, тобто мають ферментативну активність пептидаз і ДНКаз. Відомо, що аутоантитіла у хворих з недостатньою
Антитіла діють як молекули-посередники для ефекторних
1 Імунний 2 Імунний 3 Клітка-мішень / 4 Антиген
комплекс комплекс / патоген патоген